¿Qué es la tensión superficial?
La tensión superficial se define en general como la fuerza que hace la superficie (la “goma” que se menciona antes”) dividida por la longitud del borde de esa superficie (OJO: no es fuerza dividida por el área de la superficie, sino dividida por la longitud del perímetro de esa superficie).
Por ejemplo

La tensión superficial ϒ también es la energía por unidad de área que se necesita para aumentar una superficie
Como la formación de una superficie requiere energía, los líquidos minimizan su área expuesta respecto al entorno que les rodea. De ahí que las superficies de los lagos, mares, etc. En calma sean planas y los líquidos al caer tienden a Formar volúmenes esféricos (gotas)
Las fuerzas que se encargan de la tensión superficial son la adhesión y la cohesión.
Adhesión
La adhesión es la propiedad de la materia por la cual se unen y plasman dos superficies de sustancias iguales o diferentes cuando entran en contacto, y se mantienen juntas por fuerzas intermoleculares.
La adhesión ha jugado un papel muy importante en muchos aspectos de las técnicas de construcción tradicionales. La adhesión del ladrillo con el mortero (cemento) es un ejemplo claro.
Adhesión Mecánica
Los materiales adhesivos rellenan los huecos o poros de las superficies manteniendo las superficies unidas por enclavamiento. Existen formas a gran escala de costura, otras veces a media escala como el velcro y algunos adhesivos textiles que funcionan a escalas pequeñas. Es un método similar a la tensión superficial
Adhesión Química
Dos materiales pueden formar un compuesto al unirse. Las uniones más fuertes se producen entre átomos donde hay permutación (enlace iónico) o se comparten electrones (enlace covalente). Un enlace más débil se produce cuando un átomo de hidrógeno que ya forma parte de una partícula se ve atraída por otra de nitrógeno, oxígeno o flúor, en ese caso hablaríamos de un puente de hidrógeno. La adhesión química se produce cuando los átomos de la interfaz de dos superficies separadas forman enlaces iónicos, covalentes o enlaces de hidrógeno.
El principio de la ingeniería detrás de adhesión química en este sentido es bastante sencillo: si las moléculas de superficie se pueden unir, a continuación, las superficies se unen entre sí por una red de estos enlaces. Cabe mencionar que estas fuerzas iónicas y covalentes atractivas son eficaces sólo en distancias muy pequeñas – de menos de un nanómetro . Esto significa que, en general, no sólo las superficies que se quieren unir estén muy próximas entre sí, sino también, que estos enlaces sean bastante frágiles, ya que las superficies a continuación deben mantenerse juntas.
Adhesión Dispersa
En la adhesión dispersiva, dos materiales se mantienen unidos por las fuerzas de van der Waals: la atracción entre dos moléculas, cada una de las cuales tiene regiones de carga positiva y negativa. En este caso, cada molécula tiene una región de mayor carga positiva o negativa que se une a la siguiente de carga contraria. Este efecto puede ser una propiedad permanente o temporal debido al movimiento continuo de los electrones en una región.
En la ciencia de superficies el término “adhesión” siempre se refiere a una adhesión dispersiva. En un sistema sólido-líquido-gas normal (como una gota de un líquido sobre una superficie rodeada de aire) el ángulo de contacto es usado para cuantificar la adhesividad. En los casos donde el ángulo de contacto es bajo la adhesión está muy presente. Esto se debe a que una mayor superficie entre el líquido y el sólido conlleva una energía superficial mayor.
Adhesión Electrostática
Algunos materiales conductores dejan pasar electrones formando una diferencia de potencial al unirse. Esto da como resultado una estructura similar a un condensador y crea una fuerza electrostática atractiva entre materiales.
Adhesión Difusa
Algunos materiales pueden unirse en la interfase por difusión. Esto puede ocurrir cuando las moléculas de ambos materiales son móviles y solubles el uno en el otro. Esto sería particularmente eficaz con las cadenas de polímero en donde un extremo de la molécula se difunde en el otro material. También es el mecanismo implicado en sinterización. Cuando el metal o cerámica en polvo se somete a presión y se calienta, los átomos difunden de una partícula a otra. Esto hace que se homogeinice el material.
La unión por difusión se produce cuando las especies de una superficie penetran en una superficie adyacente sin dejar de ser unido a la fase de su superficie de origen. La libertad de movimiento de los polímeros tiene un fuerte efecto en su capacidad para entrelazarse, y por lo tanto, en la unión por difusión. Por ejemplo, los polímeros reticulados son menos capaces de difundir porque se unen entre sí en muchos puntos de contacto, y no son libres de girar en la superficie adyacente. Los polímeros reticulados, por el contrario, son más libres para pasear en la fase adyacente al extender las colas y los lazos a través de la interfaz.
La cohesión es la fuerza de atracción entre partículas adyacentes dentro de un mismo cuerpo, mientras que la adhesión es la interacción entre las superficies de distintos cuerpos
Cohesión
Es la atracción entre moléculas que mantiene unidas las partículas de una sustancia. La cohesión es diferente de la adhesión; la cohesión es la fuerza de atracción entre partículas adyacentes dentro de un mismo cuerpo, mientras que la adhesión es la interacción entre las superficies de distintos cuerpos.
En el agua la fuerza de cohesión es elevada por causa de los puentes de hidrogeno que mantienen las moléculas de agua fuertemente unidas, formando una estructura compacta que la convierte en un líquido casi incompresible. Al no poder comprimirse puede funcionar en algunos animales como un esqueleto hidrostático, como ocurre en algunos gusanos perforadores capaces de agujerear la roca mediante la presión generada por sus líquidos internos.
Cohesión diferentes estados
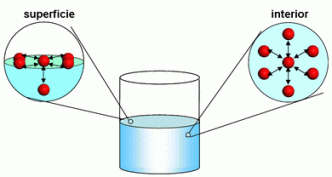
Tanto los gases como los líquidos son fluidos, pero los líquidos tienen una propiedad de la que carecen los gases: tienen una superficie “libre”, o sea tienen una superficie cuya forma no esta determinada por la forma del recipiente que lo contiene. Esta superficie se forma por una combinación de atracción gravitacional de la tierra (fuerza ocasionada por el peso) y de fuerzas entre moléculas del liquido. Una consecuencia de eso es que en la superficie de los líquidos actúa una fuerza que no esta presente en el interior de los líquidos (salvo que aya burbujas en el interior), por eso llamada “tensión superficial”. Aunque relativamente pequeña, esta fuerza es determinante para muchos procesos biológicos, para la formación de burbujas, para la formación de olas pequeñas, etc.
También en los gases, la fuerza de cohesión puede observarse en su licuefacción, que tiene lugar al comprimir una serie de moléculas y producirse fuerza de atracción suficiente mente altas para proporcionar una estructura liquida.
En los líquidos, la cohesión se refleja en la tensión superficial, causada por una fuerza no equilibrada hacia el interior del líquido que actúa sobre las moléculas superficiales, y también en la transformación de un líquido en sólido cuando se comprimen las moléculas lo suficiente. En los sólidos, la cohesión depende de cómo estén distribuidos los átomos, las moléculas y los iones, lo que a su vez depende del estado de equilibrio (o desequilibrio) de las partículas atómicas. Muchos compuestos orgánicos, por ejemplo, forman cristales moleculares, en los que los átomos están fuertemente unidos dentro de las moléculas, pero éstas se encuentran poco unidas entre sí.
En conclusión la cohesión se caracteriza así según el estado de las sustancias:
- En los sólidos, las fuerzas de cohesión son elevadas y en las tres direcciones espaciales. Cuando aplicamos una fuerza solo permite pequeños desplazamientos de las moléculas entre si, cuando cesa la fuerza exterior, las fuerzas de cohesión vuelven a colocar las moléculas en su posición inicial.
- En los líquidos, las fuerzas de cohesión son elevadas en dos direcciones espaciales, y entre planos o capas de fluidos son muy débiles. Por otra parte las fuerzas de adherencia con los sólidos son muy elevadas. Cuando aplicamos una fuerza tangencial al líquido, este rompe sus débiles enlaces entre capas, y las capas de líquido deslizan unas con otras. Cuando cesa la fuerza, las fuerzas de cohesión no son lo suficiente fuertes como para volver a colocar las moléculas en su posición inicial, queda deformado. La capa de fluido que se encuentra justo en contacto con el sólido, se queda pegada a éste, y las capas de fluido que se encuentran unas juntas a las otras deslizan entre sí.
- En los gases, las fuerzas de cohesión son despreciables, las moléculas se encuentran en constante movimiento. Las fuerzas de adherencia con los sólidos y los líquidos son importantes. Al aplicarse una fuerza de corte, se aumenta la velocidad media de las moléculas. Como estas partículas con más velocidad media (más cantidad de movimiento) se mueven en el espacio, algunas pasan a las capas contiguas aumentando a su vez la velocidad media de esas capas adyacentes, estas a su vez con una cantidad de movimiento más pequeña, algunas de sus partículas pasan a la capa de mayor cantidad de movimiento (afectada por el esfuerzo de corte) frenándola.
Aplicación
Como podemos comprobar en la vida cotidiana, estas fases de la materia, se aplican a casi todos los campos de la técnica:
– Redes de distribución.
– Regulación de máquinas.
– Transmisiones de fuerza y controles hidráulicos y neumáticos.
– Acoplamientos y cambios de marcha.
Webgrafía:
- https://es.wikipedia.org/wiki/Tensi%C3%B3n_superficial
- https://okdiario.com/curiosidades/que-tension-superficial-2582748
- http://www.sc.ehu.es/sbweb/fisica/fluidos/tension/introduccion/introduccion.htm
- https://hernanleon1002.wordpress.com/fisica-de-fluidos-y-termodinamica/segundo-corte/marco-teorico/tension-superficial/




Comentarios
Publicar un comentario